|
Dernière mise à jour le
|
Visualisation des brassages génétiques lors de la méiose
chez un être vivant haploïde : Sordaria
chez un être vivant haploïde : Sordaria
T.P. Corrigé
Le cycle vital chez Sordaria.
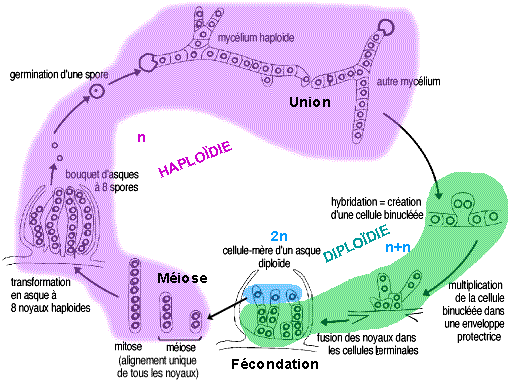
Le choix de Sordaria pour l'étude du brassage lors de la méiose
- Le soma de Sordaria est haploïde : le phénotype observé peut donc être traduit en génotype de façon certaine contrairement à un soma diploïde pour lequel un phénotype dominant peut être l'expression d'un génotype homozygote dominant ou hétérozygote.
- " Les produits des divisions (les spores) sont alignés chez les Ascomycètes, cela permet de retracer le comportement des chromosomes lors des divisions, c’est un cas exceptionnel dans le monde vivant. "
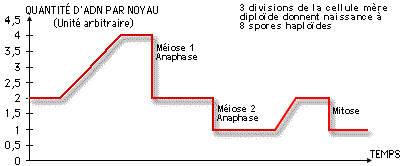
Trois divisions successives donnent naissance à 8 spores haploïdes rangées alignées dans un asque
- La germination d"une spore qui donne le mycélium, est une reproduction conforme par mitoses.
|
Évolution de la quantité d’ADN par noyau au cours des divisions successives subies par le noyau de fécondation.
|
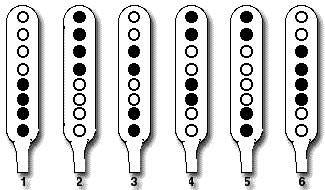
Différents types d’asques hétérogènes selon la position des spores noires et albinos dans un asque
|
 |
 |
|
|
Types
|
||||||
| Pour un total de 68 asques |
1
|
2
|
3
|
4
|
5
|
6
|
| Nombre d’asques du type |
18
|
17
|
9
|
7
|
8
|
9
|
| Taux d’asques du type |
26,5%
|
25%
|
13,2%
|
10,3%
|
11,8%
|
13,2%
|
- On observe une équiprobabilité statistique d'obtenir des asques de type 4/4 ou 2/2/2/2.
- À l'intéreiur de chaque catégorie les types de répartissent à leur tout de manière équiprobable :
- 25 % de cahnce d'obtenir nnbb ou bbnnn,
- 12,5% de chances d'obtenir un type 2/2/2/2 ou 2/4/2.
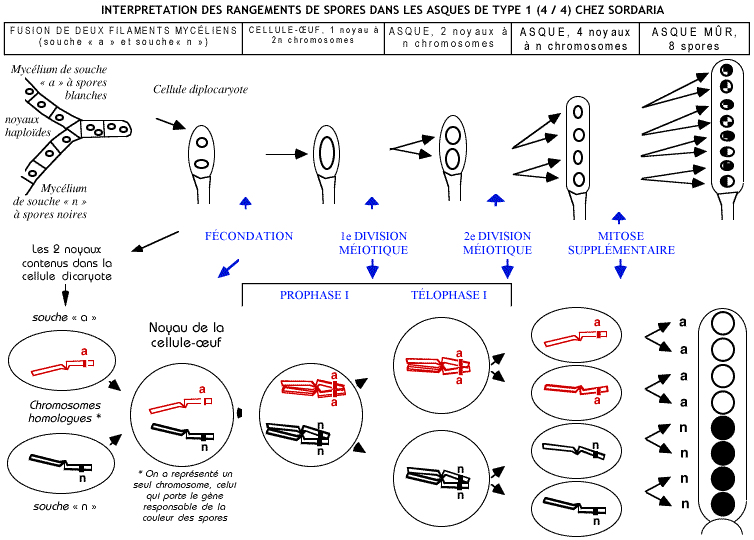
Interprétation des asques dont les spores sont disposées suivant le type 4/4
- Le comportement des chromosomes lors de la fécondation puis de la méiose explique la disposition des spores dans les asques de types 1 et 2.
- Dans ces types, la ségrégation des allèles a et N s’effectue dès la division I réductionnelle de la méiose..
- Nous savions que deux allèles sont deux formes d'un même gène, à cela nous pouvons ajouter que deux allèles sont portés par un même locus d’une paire de chromosomes homologues et qu'ils sont disjoints, séparés, par la méiose.
- Remarque : si on avait pris comme préalable que la couleur des spores était définie par deux gènes différents, ils n’auraient pas été systématiquement disjoints ; ce préalable se serait montré erroné puisque dans tous les cas nous avons observés que les allèles sont systématiquement disjoints par la méiose.
- L’égalité statistique (équiprobabilité) des types 1 et 2 montre que la séparation des chromosomes homologues à l’anaphase I est aléatoire (due au hasard).
- Si on envisage toutes les paires de chromosomes de l'espèce (n = 7), cette séparation aléatoire des chromosomes homologues conduit à un brassage entre les chromosomes d'origine paternelle et maternelle dans les spores (ou les gamètes), c'est le brassage interchromosomique, d’autant plus important que le nombre de paires de chromosomes est important (rappelons que les combinaisons possibles sont 2n).
Interprétation des asques dont les spores sont disposées suivant le type 2/2/2/2
Utilisation des documents
- La différence de positionnement des gènes Gl et G2 étudiée ici concerne leur distance par rapport au centromère du chromosome :
- elle est faible pour G1
- elle est grande pour G2.
- Or dans le cas de G1 on observe 100% d’asques de type 4/4 et dans le cas de G2 on observent les 6 types d’asques (4/4 et 2/2/2/2). Cela laisse à supposer qu'il y a eu échange d'une portion de chromatide entre deux chromosomes appariés. Cet échange ne peut avoir eu lieu qu'au stade "chromosomes appariés" en fin de prophase 1. Cet échange n'est que partiel et ne concerne que les fragments suffisamment éloignés du centromère.
- Cet enjambement des chromatides de deux chromosomes appariés, avec échange d'un fragment se nomme un CROSSING-OVER.
- Il faut impérativement admettre que chaque chromosome en fin de division I de la méiose possède un allèle a sur un chromatide et un allèle N sur l'autre (chromosome recombiné ou remanié). Une mutation ne peut expliquer le phénomène. Les chromatides entiers n’ont pu être échangés, le centromère n'étant pas divisé, c'est donc un échange d’une partie de chromatide. Ce phénomène n'est possible qu'en prophase I, durant le stade chromosomes bivalents.
- Ceci est donc explicable par l’échange réciproque des segments de chromatides portant les allèles considérés, échange effectué entre les deux chromosomes homologues en prophase I, lors de l’appariement des chromosomes homologues. Cet échange porte le nom de crossing-over (nom donné au phénomène ou enjambement), il est visible au niveau d'un chiasma (nom de la forme visible).
- Après un crossing-over en fin de prophase I, les deux chromatides d'un chromosome ne possèdent plus la même combinaison d’allèles que celle d'origine (paternelle et maternelle). Un crossing-over détermine un brassage intrachromosomique. Ce brassage est plus ou moins important, il dépend de la longueur du segment de chromatide échangé (dizaines ou milliers de gènes).
- Chez un haploïde, comme Sordaria, le brassage intrachromosomique est immédiatement révélé par la disposition des spores.
Schéma interprétatif pour un asque de type 3 (2/2/2/2)
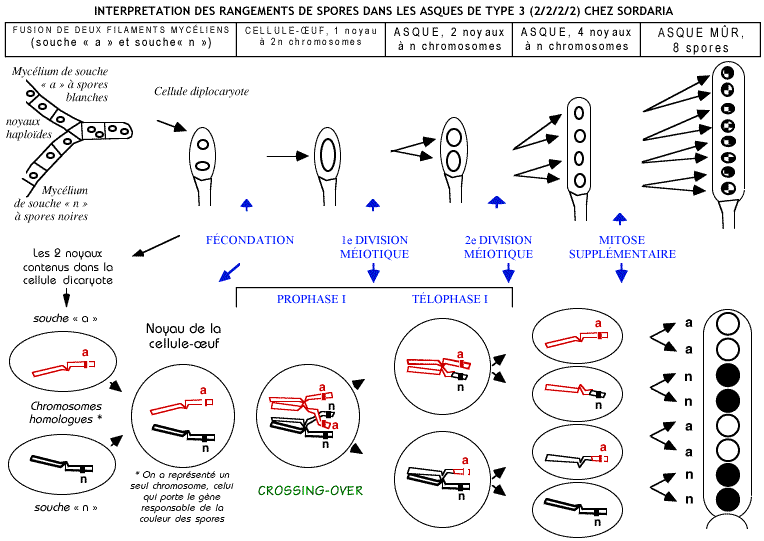
Bilan
- La reproduction sexuée est source de diversité chez les haploïdes car durant la méiose ont lieu successivement :
- en prophase I, des crossing-over, responsables d'un brassage intrachromosomique
- les chromosomes paternels ou maternels sont remaniés, un chromosome remanié comporte maintenant des gènes d'origine parternelle associés à des gènes d'origine maternelle. Les chromosomes paternels et maternels ne seront donc pas transmis dans leur intégralité.
- La séparation des chromosomes aura lieu en méiose 2.
- au cours de l’anaphase I, se réalise un brassage interchromosomique qui répartit de façon aléatoire les chromosomes homologues (il s’effectue sur les chromosomes remaniés ou non).